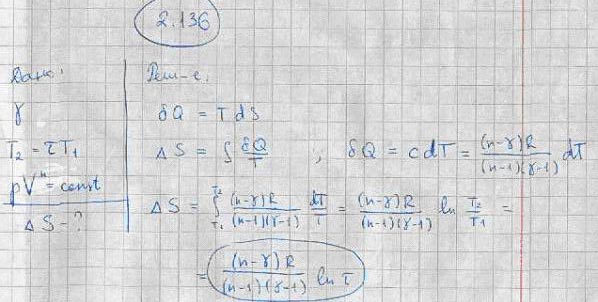
Так что же такое энтропия?
Пример 1. Согласно первому началу термодинамики ;. Из уравнения Менделеева — Клапейрона давление , то.










Поиск Настройки. Время на прочтение 7 мин. Научно-популярное Физика. Пожалуй, это одно из самых сложных для понимания понятий, с которым вы можете встретиться в курсе физики, по крайней мере если говорить о физике классической.
- Зависимость энтропии от давления
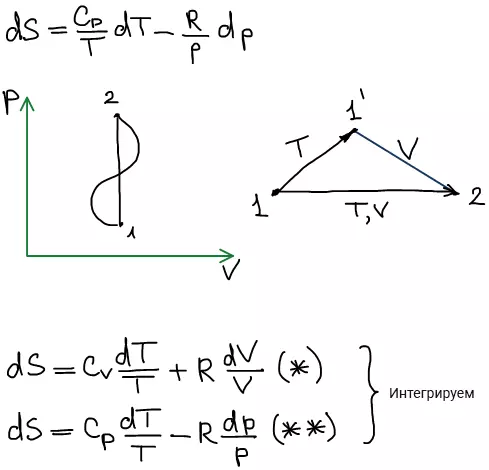
- Объединенное уравнение первого и второго законов термодинамики 3. После интегрирования 3.
- Энтропия — это фундаментальная физическая величина. Введение этого понятия завершило этап становления понятийного аппарата термодинамики.
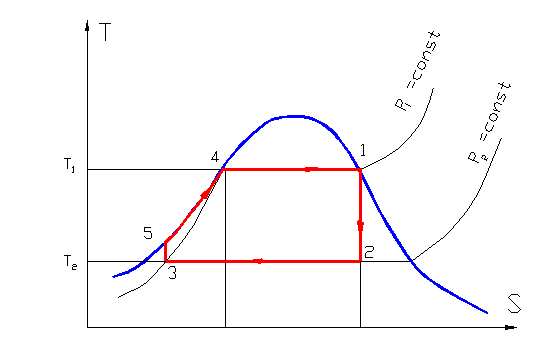
- При обратимом процессе сумма приведенных количеств тепла Выясним, в каком соотношении находятся сумма приведенных количеств тепла и приращение энтропии при необратимом процессе.
- Примеры решения задач
- Рассмотрим, как изменится энтропия одного моля газа при изменении объема системы.
- Идеальный газ - математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
- Форум сайта alsak.


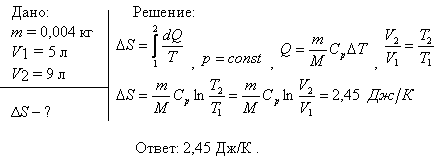





| Формула Больцмана | 59 | Изменение энтропии одного моля идеального газа при переходе системы из состояния 1 в состояние Задача 1. |
| Зависимость энтропии от температуры | 458 | Процесс протекает в отсутствие теплообмена с окружающими телами. Газ расширяется «в пустоту» без совершения работы и без теплообмена с окружающими телами. |
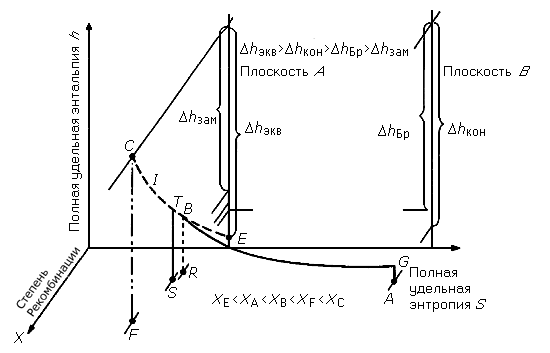
| 143 | В этом разделе обсуждаются еще два параметра, которые связаны со структурными и энергетическими изменениями молекул. Все химические реакции сопровождаются выделением или поглощением тепла. | |
| 332 | Энтропия является функцией состояния и широко используется в термодинамике , в том числе технической анализ работы тепловых машин и холодильных установок и химической расчёт равновесий химических реакций. Утверждение о существовании энтропии и перечисление её свойств составляют содержание второго и третьего начал термодинамики. | |
| 474 | Случай а понятно, но что-то б не получилось. На счет энтропии системы : Почему изменение энтропии системы для б будет таким же как в а? | |
| 492 | Решая задачи на применение уравнения Клапейрона - Менделеева, не следует забывать, что данное уравнение описывает состояние идеального газа. |
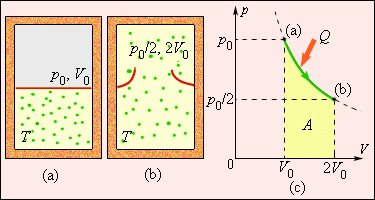
Рассмотрим жесткий сосуд, имеющий объем V и разделенный перегородкой на две части рис. Одну часть сосуда с объемом V 1 занимает газ при температуре Т ОС , равной температуре окружающей среды, в другой части сосуда — абсолютный вакуум. Поскольку газ и окружающая среда имеют одинаковые температуры, такая термодинамическая система находится в равновесном состоянии. Если убрать перегородку рис. Это типичный необратимый процесс, сопровождающийся увеличением энтропии системы и потерей возможной работы эксергии. Получим расчетное выражение для изменения энтропии в такой системе при расширении газа в вакуум и убедимся, что энтропия системы возрастет.